18 Февраля
18 февраля 1913 — Фредерик Содди предлагает термин «изотоп».
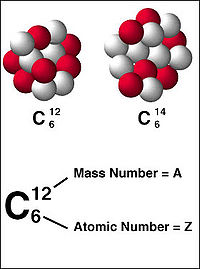
Изотопы (от др. греч. ισος — «одинаковый», «равный», и τόπος — «место») — это разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковый атомный номер, но при этом разные массовые числа. Такое название связано с тем фактом, что все изотопы одного атома помещаются в одно и то же место (в одну клетку) таблицы Менделеева. Химические свойства атома зависят от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z, и практически не зависят от его массового числа A. Все изотопы одного элемента имеют одинаковый заряд ядра, при этом в них отличается только количество нейтронов. Как правило изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, который обозначает массовое число. Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные собственные названия (например, актинон, дейтерий).
История открытия изотопов
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут обладать различными физическими свойствами, было получено в ходе исследования радиоактивных превращений атомов тяжёлых элементов. В 1906—1907 годах стало известно, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий имеют те же химические свойства, что и торий, отличаясь от него атомной массой и характеристиками радиоактивного распада. Позднее было обнаружено, что у всех трёх продуктов одинаковые оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Содди с 1910 года получили название изотопов.
Изотопы в природе
Считается, что изотопный состав большинства элементов на Земле одинаков во всех материалах. Некоторые физические процессы в природе приводят к нарушению изотопного состава элементов. Постепенное накопление в минералах ядер — продуктов распада некоторых долгоживущих нуклидов используется в ядерной геохронологии. Особое значение имеют процессы образования изотопов углерода в верхних слоях атмосферы под воздействием космического излучения. Эти изотопы распределяются в атмосфере и гидросфере планеты, вовлекаются в оборот углерода живыми существами (растениями и животными). Изучение распределения изотопов углерода лежит в основе радиоуглеродного анализа.